《醫療器械監督管理條例》(國務院第739號令)在第二章第十四條“產品檢驗報告應當符合國務院藥品監督管理部門的要求,可以是醫療器械注冊申請人、備案人的自檢報告,也可以是委托有資質的醫療器械檢驗機構出具的檢驗報告”。自此,醫療器械自檢與委托檢驗在醫療器械上位法中得以明確,醫療器械檢測實現了雙渠道檢測。
相信大家對醫療器械注冊檢驗并不陌生,很多企業的檢測人員都有在國家局認可的醫療器械檢測機構進行排隊等待產品檢測的經歷。隨著醫療器械檢測雙渠道的開放,在一定程度上緩解了這些指定檢測機構的承檢壓力,同時加速推動了醫療器械檢測速度和檢測能力的提升,尤其對于體外診斷試劑產品來說,產品基本性能檢測不需要依靠大型專業設備,因此,大部分產品都可以實現醫療器械自檢。那么,什么是醫療器械自檢與委托檢驗?什么樣的企業適用醫療器械注冊自檢呢?
為加強醫療器械注冊管理,規范注冊申請人注冊自檢工作,確保醫療器械注冊檢驗工作有序開展,2021年10月,國家藥品監督管理局發布了《醫療器械注冊自檢管理規定》(以下簡稱《自檢管理規定》),并于發布之日起實施。該《自檢管理規定》中,從自檢能力、自檢報告、委托檢驗、申報資料、責任等五個部分展開詳述。
醫療器械注冊自檢的核心要素包括哪些?
醫療器械注冊自檢是醫療器械注冊申請人按照產品技術要求,自行對其申報的產品進行全項檢測,并出具自檢報告,醫療器械自檢工作需要納入醫療器械質量管理體系中。對于不具備產品技術要求中部分條款項目檢驗能力,可以將相關條款項目委托有資質的醫療器械檢測機構進行檢測。關于醫療器械檢驗機構應當具備的資質在《醫療器械監督管理條例》第七十五條中有相關規定,在此不再贅述。
那么,此次發布的《自檢管理規定》核心要素包括哪些?據從事醫療器械法規咨詢10年的資深品牌邁迪思創公司分析,可以總結出四個核心要素:首先是人,自檢企業應配備專職的檢驗人員、審核人員和批準人員,并且這些專職人員具備相應的教育背景、技術能力、經過專業培訓和考核;其次是環境和設備,注冊申請人應當配備滿足檢驗方法要求的儀器設備和環境設施,建立和保存相關檔案、規程和記錄等;第三,樣品,確保樣品受控并保持相應狀態;第四,合法合規,以產品技術要求為依據,公認的檢驗方法優先,且進行方法驗證和確認。邁迪思創公司還進一步強調,企業自檢的全過程要確保結果真實、準確、完整和可追溯。
哪種類型的國產企業適合醫療器械注冊自檢?
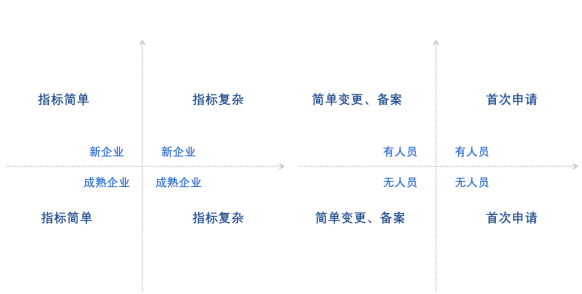
對于國產企業在什么情況下適合選擇醫療器械注冊自檢路徑?邁迪思創根據自己對于法規的研究與理解,建議企業建立風險評估矩陣,來分析和平衡自身的檢驗風險與企業能力之間的關系。該矩陣從八個維度進行綜合分析,包括企業類型是成熟型企業或新成立企業;技術指標的復雜或簡單程度;是否具備相應能力的人員;申報的方式是簡單變更、備案,還是首次申請。邁迪思創也進行了舉例說明,比如一個產品技術指標復雜的新企業計劃進行首次申請,暫時沒有招聘到專職的檢驗人員,那么,其實該企業是不適合采用自檢報告的方式進行遞交的,建議采用國家藥監部門認可、具有資質的檢測機構進行注冊檢驗。
通過上述分析,讓我們對醫療器械注冊自檢有了框架性的認識。雖然注冊自檢的認可使得企業在醫療器械注冊、醫療器械臨床試驗等工作開展中有了更多的選項,但是,我們也看到醫療器械自檢對企業自身的要求非常嚴格。在2021年召開的“第十二屆中國醫療器械監督管理國際會議”上,器械審評中心的專家表示,自檢是現階段檢查與管理的重點方向,但不是醫療器械檢測的唯一路徑,建議企業在初期做好審慎評估,再進行遞交。
免責聲明:市場有風險,選擇需謹慎!此文僅供參考,不作買賣依據。
關鍵詞:
凡注有"實況網-重新發現生活"或電頭為"實況網-重新發現生活"的稿件,均為實況網-重新發現生活獨家版權所有,未經許可不得轉載或鏡像;授權轉載必須注明來源為"實況網-重新發現生活",并保留"實況網-重新發現生活"的電頭。





